- El beneficio por acción de actividades recurrentes creció un 7% a tipos de cambio constantes (0% en francos suizos).
- Buen incremento de las ventas en la cartera oncológica, particularmente de los medicamentos contra el cáncer de mama HER2-positivo: Herceptin®, Perjeta® y Kadcyla®.
- Buenos datos de crecimiento de la División Diagnostics, especialmente en el negocio de Professional Diagnostics.
- La FDA designa como avance terapéutico decisivo un inmunoterápico oncológico anti-PDL1 en investigación.
- Un panel de expertos recomienda la autorización de Gazyvaro® en la UE para el tratamiento de la leucemia linfocítica crónica.
- Se confirman las perspectivas para el ejercicio completo.
Basilea, 24 de julio de 2014
1 Salvo indicación en contrario, todas las tasas de crecimiento se expresan a tipos de cambio constantes (promedio de todo el ejercicio de 2013).
2 NIIF (IFRS): Normas Internacionales de Información Financiera.
Ante el balance semestral de Roche, Severin Schwan, director general (CEO) de Roche, ha destacado “los buenos resultados durante el primer semestre, con las ventas impulsadas primordialmente por nuestros nuevos medicamentos contra el cáncer de mama, Perjeta® y Kadcyla®, así como por Diagnostics. Ha habido avances significativos en nuestra cartera de desarrollo como muestra que la FDA designara como “avance terapéutico decisivo” nuestro inmunoterápico oncológico anti-PDL1 en investigación, admitiera a trámite con carácter prioritario la solicitud de dos nuevas indicaciones de Avastin® y decidiera la tramitación rápida de un nuevo y prometedor antibiótico. En la División Diagnostics, obtuvimos una aprobación importante de la FDA para el uso de nuestra prueba del virus del papiloma humano (VPH) en el cribado primario del cáncer de cuello uterino. Considerando los resultados de este primer semestre, tengo confianza en que alcanzaremos nuestros objetivos para el ejercicio completo de 2014”.
Resultados del Grupo
Los medicamentos contra el cáncer de mama HER2-positivo impulsan el crecimiento
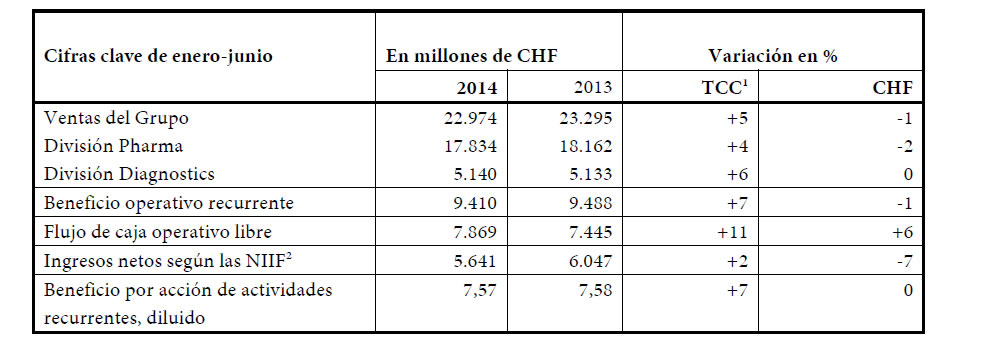
Las ventas del Grupo avanzaron hasta los 22.974 millones de CHF (+5%), con un fuerte crecimiento de los medicamentos contra el cáncer de mama HER2-positivo Herceptin®, Perjeta® y Kadcyla®, de otros antitumorales como Avastin® y MabThera®/Rituxan® y de Actemra®/RoActemra® contra la artritis reumatoide. Las ventas de Xeloda®, un quimioterápico ya sin protección de patente, disminuyeron en varios mercados ante la competencia de los genéricos. En la División Diagnostics se mantuvo la fuerte demanda de los productos de Professional Diagnostics para laboratorios clínicos, mientras que las ventas de Diabetes Care permanecieron sin cambios.
Las ventas contabilizadas en CHF disminuyeron un 1% con respecto a la primera mitad de 2013 ante el debilitamiento del dólar estadounidense, de varias divisas latinoamericanas y del yen japonés frente al franco suizo.
Aumento del beneficio operativo recurrente y del flujo de caja
El beneficio operativo recurrente del Grupo aumentó un 7%1 en el primer semestre como consecuencia del fuerte resultado operativo y de la contención de costos en ambas divisiones. El beneficio por acción de actividades recurrentes también creció un 7%, situándose en 7,57 francos suizos. El flujo de caja operativo libre fue de 7.869 millones de CHF, lo que significa un aumento del 11% en el primer semestre. La generación de efectivo fue fuerte en ambas divisiones a pesar del aumento del capital de explotación neto y de las inversiones de capital en desarrollo de los centros y en expansión de la capacidad productiva. El capital de explotación neto creció a causa de los mayores niveles de inventario para garantizar el suministro a los pacientes. Los ingresos netos según criterios NIIF, que incluyen pérdidas por deterioro de activos de 414 millones de CHF relacionadas con activos intangibles en Tissue Diagnostics, ascendieron a 5.641 millones de CHF, lo que supone un incremento del 2% a tipos de cambio constantes con respecto al primer semestre de 2013.
1 El beneficio operativo recurrente del Grupo incluye algunas partidas extraordinarias como los beneficios por la venta de los derechos de la franquicia del filgrastim a su titular original Amgen y el efecto base de ingresos derivados de cambios en los planes de pensiones del Grupo en 2013. En conjunto, el impacto material neto sobre los resultados fue nulo.
Avances significativos en la cartera de desarrollo de Pharma
Actualmente contamos con 66 nuevos principios activos en desarrollo clínico, de los que 12 se encuentran en fase avanzada del desarrollo.
En el 50 Congreso de la Sociedad Estadounidense de Oncología Clínica, celebrado en el semestre pasado, Roche presentó datos de 27 medicamentos, entre los que destacan los resultados de un estudio de fase I que mostraron cómo MPDL3280A, inmunoterápico oncológico anti-PDL1 en
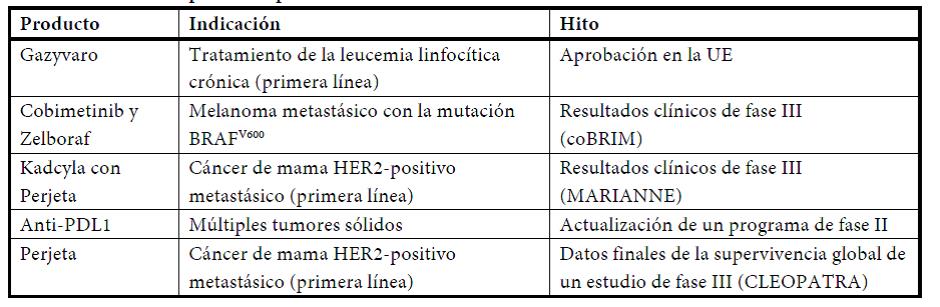
investigación, redujo el tamaño del tumor en pacientes con cáncer de vejiga avanzado. La FDA ha designado a este fármaco como “avance terapéutico decisivo”. Este mismo año, el fármaco anti-PDL1 pasaba a la fase III de la investigación clínica en la indicación cáncer de pulmón, y está en marcha un amplio programa de desarrollo en varias otras indicaciones y combinaciones.
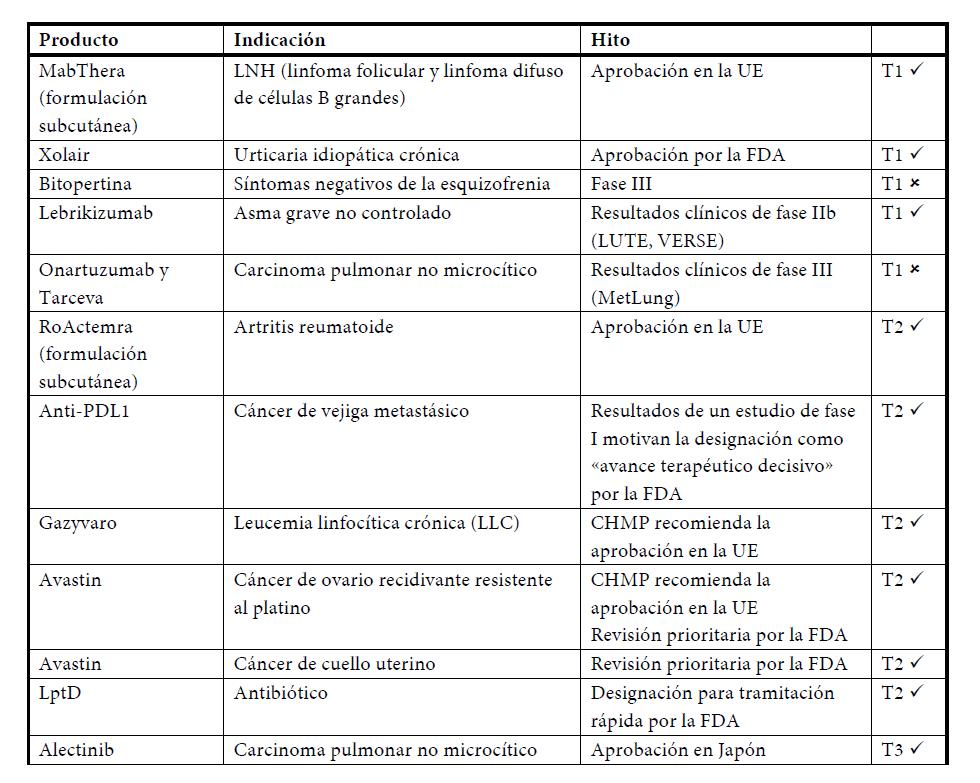
A lo largo de toda la primera mitad del año hubo noticias positivas del registro farmacéutico, como la autorización en la UE de las formulaciones subcutáneas de MabThera®/Rituxan® contra la leucemia y de Actemra®/RoActemra® contra la artritis reumatoide. El Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos también recomendó la autorización de Gazyvaro® (conocido como Gazyva fuera de la UE) para el tratamiento de la leucemia linfocítica crónica y de Avastin® contra el cáncer de ovario recurrente resistente al platino. En los Estados Unidos, la FDA admitió con carácter prioritario las solicitudes de autorización de Avastin® para el tratamiento del cáncer de cuello uterino y el cáncer de ovario resistente al platino, y decidió la tramitación rápida de un nuevo antibiótico que actúa sobre la proteína LptD y está siendo objeto de estudios de fase II. En Japón, Alecensa® (alectinib) recibió en julio la autorización para el tratamiento del carcinoma pulmonar no microcítico ALK-positivo tras la realización de un estudio en ese país. Por otra parte, la FDA ha designado como “avance terapéutico decisivo” al alectinib, que está siendo actualmente objeto de varios estudios internacionales.
Otro hito importante fue la aprobación por la FDA de una nueva indicación de Xolair®, que ahora puede utilizarse contra la urticaria idiopática crónica (habones crónicos que provocan un picor intenso). Esta indicación se suma al uso actual en el asma alérgico. Los datos clínicos de fase II del lebrikizumab, un producto en desarrollo contra el asma grave, fueron positivos en un subgrupo de pacientes identificables mediante una prueba diagnóstica asociada. Otro medicamento en investigación, el cobimetinib, utilizado en combinación con Zelboraf®, medicamento contra el cáncer de piel, también tuvo unos primeros resultados positivos en el melanoma avanzado.
Confirmadas las perspectivas para el ejercicio completo
Para el ejercicio 2014, Roche espera un crecimiento de las ventas del Grupo en la zona baja o media de un dígito a tipos de cambio constantes. De igual modo, Roche aspira a que el beneficio por acción de actividades recurrentes crezca por encima de las ventas; asimismo, espera un nuevo incremento de su dividendo.
División Pharma
Las ventas de la División Pharma crecieron un 4%. En los Estados Unidos (+5%), el crecimiento se vio impulsado por las ventas de los medicamentos contra el cáncer de mama HER2-positivo, que avanzó un 30%, y por las ventas de Avastin® en las indicaciones cáncer colorrectal y cáncer de pulmón. También se elevaron las ventas de Xolair, que recibió la autorización para una nueva indicación —el tratamiento de la urticaria crónica—, y del medicamento oftálmico Lucentis®. Las ventas del quimioterápico Xeloda® disminuyeron, ya que ha dejado de tener protección de patente en los Estados Unidos y se enfrenta a la competencia de genéricos.
En Europa (+3%), la facturación también recibió el impulso de los medicamentos contra el cáncer de mama HER2-positivo, además de los antitumorales MabThera®/Rituxan® y Avastin® y del antigripal Tamiflu® en el Reino Unido.
En Japón, el aumento del +7% en las ventas reflejó un fuerte crecimiento de los fármacos contra el cáncer de mama HER2-positivo y la mayor demanda de Avastin® en las indicaciones cáncer de mama y cáncer de pulmón, así como de Actemra®/RoActemra® contra la artritis reumatoide.
En la región Internacional (+2%), el motor del crecimiento de las ventas fue Latinoamérica (+11%), en particular Brasil, Argentina y Venezuela; en Oriente Próximo, la inestabilidad política tuvo un impacto negativo en las ventas. En China cayó la facturación un 1% debido en primer lugar a las menores ventas de Tamiflu®. Las ventas de los medicamentos contra el cáncer de mama HER2-positivo, así como de MabThera®/Rituxan®, Avastin® y Actemra®/RoActemra®, permanecieron sólidas en China.
Sigue aumentando la demanda de antineoplásicos
La cartera de oncología continuó impulsando el crecimiento en todas las regiones. Las ventas de los medicamentos contra el cáncer de mama HER2-positivo crecieron (+20%), con una fuerte demanda de los nuevos productos Perjeta® y Kadcyla®, así como de Herceptin® en combinación con Perjeta®. Avastin® (+6%) también registró un fuerte crecimiento en todas las regiones, particularmente en las indicaciones cáncer colorrectal y cáncer de ovario. MabThera®/Rituxan® (+4%), ahora disponible en Europa en una formulación subcutánea, registró un crecimiento robusto en la mayoría de las regiones.
Buenos resultados en inmunología y oftalmología
Las ventas de Actemra®/RoActemra® (+22%), medicamento contra la artritis reumatoide, aumentaron significativamente en todos los mercados importantes. La nueva formulación subcutánea ha tenido una buena acogida en Estados Unidos, y ahora ha sido autorizada también en Europa. Las ventas del fármaco oftálmico Lucentis® (+6%), comercializado por Roche en los Estados Unidos, siguieron creciendo ante el incremento de su uso para el tratamiento del edema macular diabético.
Adquisición de Seragon Pharmaceuticals
El 2 de julio de 2014, el Grupo dio a conocer un acuerdo para adquirir una participación del 100% en Seragon Pharmaceuticals, Inc., una empresa de titularidad privada con sede en San Diego, California. Se espera cerrar la transacción en el tercer trimestre de 2014. Con esta adquisición, el Grupo obtendrá los derechos sobre la cartera completa de los degradadores selectivos de los receptores de estrógeno (SERD por sus siglas en inglés) de Seragon para el potencial tratamiento de cánceres positivos para receptores hormonales. El primer candidato de este grupo de fármacos de Seragon, ARN-810, es un SERD de última generación, actualmente en investigación clínica de fase I en pacientes con cáncer positivo para receptores hormonales que no han respondido a fármacos hormonoterápicos utilizados en la actualidad. La adquisición tendrá un coste de 725 millones de USD en efectivo y hasta 1.000 millones de USD en función del logro de determinados hitos.
Productos principales
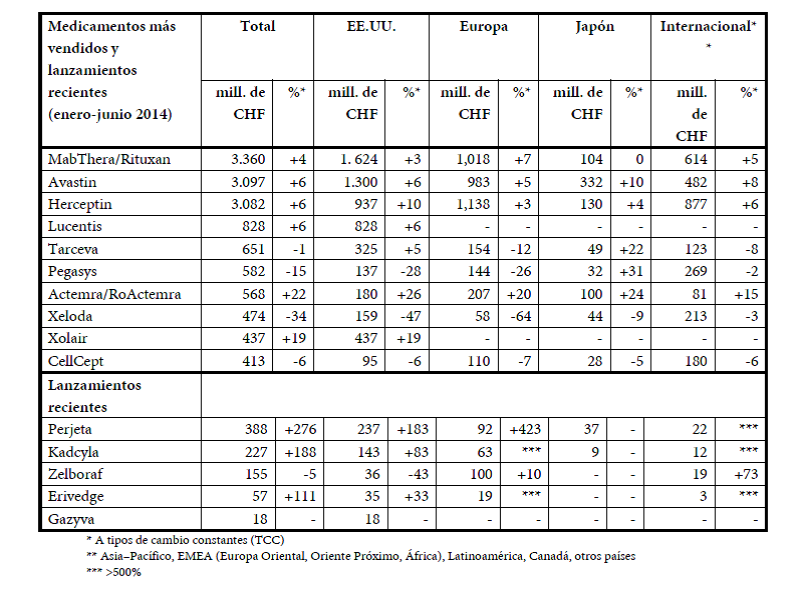
- Medicamentos HER2 Herceptin®, Perjeta® y Kadcyla® (+20%), contra el cáncer de mama HER2-positivo y el cáncer de estómago HER2-positivo metastásico (avanzado). El crecimiento de las ventas de Herceptin® (+6%) se vio impulsado especialmente en los Estados Unidos (+10%) por el mayor uso contra el cáncer de mama en combinación con Perjeta®. La región Internacional también registró un fuerte crecimiento de la facturación (+6%), el cual alcanzó cifras significativas en Brasil y China. En Europa, las ventas registraron un incremento del 3%. La formulación subcutánea, aprobada en 2013, tuvo una buena acogida y está ahora comercializada en 20 mercados, incluidos los de Alemania y el Reino Unido. En Japón, la facturación creció un 4% y aumentó el uso en combinación con Perjeta®, recientemente lanzado. Perjeta® (388 millones de CHF) se utiliza en combinación con Herceptin® para el tratamiento de primera línea del cáncer de mama metastásico HER2-positivo, y también se ha aprobado en los Estados Unidos para el tratamiento neoadyuvante (prequirúrgico) del cáncer de mama. La demanda en los Estados Unidos se mantiene alta en ambas indicaciones. En Europa, la acogida fue fuerte para el tratamiento de primera línea del cáncer de mama metastásico, sobre todo en Alemania, Francia y el Reino Unido. Kadcyla® (227 millones de CHF) es un conjugado de anticuerpo y fármaco que se une a las células cancerosas HER2-positivas y lleva el quimioterápico antineoplásico directamente a esas células, lo que le confiere una alta potencia con menos efectos adversos. Actualmente está autorizado en numerosos mercados importantes, incluidos Estados Unidos y Europa, en los que tiene una buena acogida y la demanda se mantiene fuerte. Ahora se ha alcanzado también un acuerdo para el reembolso en Japón y Brasil tras la aprobación es estos países a finales de 2013 y comienzos de 2014, respectivamente.
- MabThera®/Rituxan® (+4%), contra formas comunes de cánceres hemáticos, linfomas no hodgkinianos (LNH) y leucemia linfocítica crónica (LLC), así como contra la artritis reumatoide (AR). También se utiliza en el tratamiento de la granulomatosis con poliangitis (GPA) y la poliangitis microscópica (PAM), dos tipos de vasculitis asociada a ANCA (anticuerpos anticitoplasma de los neutrófilos). Las ventas se elevaron un 4%, registrándose un fuerte crecimiento en Europa (+7%) donde estuvieron impulsadas por una mayor cuota de mercado tanto contra los linfomas foliculares como en el tratamiento de primera línea de la LLC. En los Estados Unidos, las ventas se elevaron un 3%. En los mercados de la región Internacional, la facturación creció un 5% impulsada por Latinoamérica. La formulación subcutánea de MabThera® en los LNH se aprobó en Europa y Australia.
- Avastin® (+6%), contra el cáncer colorrectal, de mama, de pulmón, de riñón y de ovario y contra el glioblastoma (un tipo de tumor cerebral). Las ventas en los Estados Unidos crecieron un 6%, con una demanda constante para el tratamiento del cáncer colorrectal y de pulmón. En Europa, las ventas se elevaron un 5% gracias al mayor uso contra el cáncer de ovario. El incremento de las ventas del 8% en la región Internacional obedeció en buena medida a los lanzamientos contra el cáncer de ovario y el cáncer colorrectal. En Japón (+10%) creció la demanda contra en el cáncer de pulmón y el de mama.
- Lucentis® (+6%, Estados Unidos solamente), contra enfermedades oculares, concretamente contra la degeneración macular senil húmeda (DMSh), el edema macular por oclusión de vena retiniana (OVR) y el edema macular diabético (EMD). El crecimiento estuvo impulsado fundamentalmente por el uso de Lucentis para tratar el EMD.
- Actemra®/RoActemra® (+22%), contra la artritis reumatoide (AR), la artritis idiopática juvenil sistémica (AIJs) y la artritis idiopática juvenil poliarticular. Las ventas registraron un fuerte crecimiento en todos los mercados principales (Estados Unidos +26%; Europa +20%; región Internacional +15%; Japón +24%) gracias a la fuerte demanda para el uso monoterápico en la artritis reumatoide. En los Estados Unidos se lanzó una nueva formulación subcutánea de Actemra®/RoActemra® y las ventas están creciendo bien. Esta formulación fue aprobada después en Europa y Canadá y la acogida inicial ha sido positiva.
- Zelboraf® (-5%), contra el melanoma metastásico positivo con la mutación BRAFV600, fue lanzado en 2011 y está aprobado en más de 80 países. Actualmente está afrontando una fuerte competencia de un tratamiento combinado alternativo en los Estados Unidos (-43%), mientras que en Europa crecieron las ventas un 10%. En julio se comunicaron los primeros resultados del estudio fundamental coBRIM, en el que se compara la combinación del cobimetinib (inhibidor de MEK) con Zelboraf® frente a Zelboraf® en monoterapia, los cuales revelaban que se habían alcanzado las variables principales de valoración. Los datos completos se esperan presentar antes de finalizar el año.
- Gazyva®/Gazyvaro® (18 millones de CHF), para el tratamiento de primera línea de la leucemia linfocítica crónica (LLC). Gazyva®, aprobado en noviembre de 2013 en los Estados Unidos, fue designado por la FDA como “avance terapéutico decisivo2 y está incluido en las guías de tratamiento de la LLC de la National Comprehensive Cancer Network (Red Nacional de Centros Oncológicos Integrales). En mayo, el Comité de Medicamentos de Uso Humano (CHMP) de la UE recomendó la aprobación de Gazyva® (que se venderá con el nombre de Gazyvaro® en Europa) para el tratamiento de la LLC en Europa en pacientes que no toleren la quimioterapia agresiva. En Suiza está ya aprobado y se espera su autorización en varios mercados clave antes de finalizar 2014.
Importantes noticias de estudios clínicos y registro farmacéutico hasta el 24.07.2014
Noticias clínicas de próxima aparición
División Diagnostics
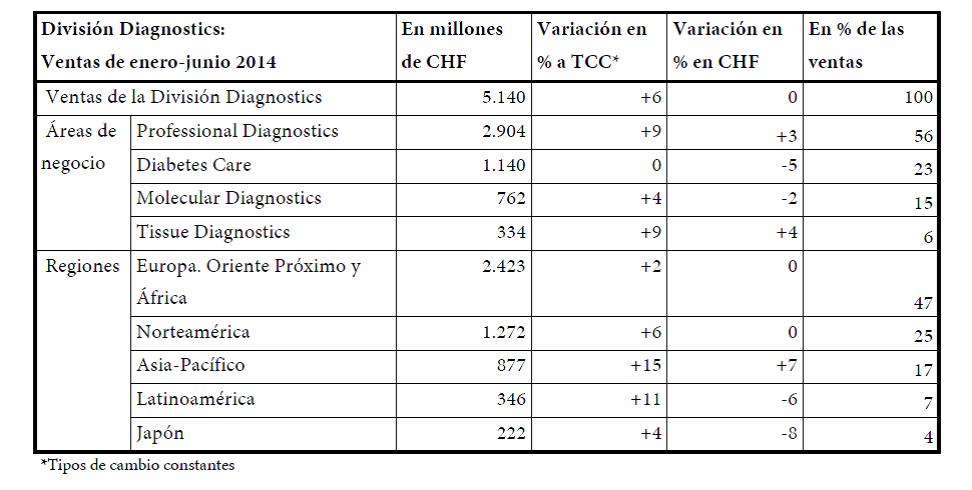
Fuerte crecimiento en los seis primeros meses del año
La División Diagnostics continuó incrementando sus ventas, con un fuerte crecimiento del 6% que le permitió alcanzar los 5.100 millones de CHF. Professional Diagnostics fue la unidad que más contribuyó al crecimiento con un aumento de las ventas del 9%, lideradas por el negocio de inmunodiagnóstico (+12%). La facturación de Molecular Diagnostics creció un 4%. En Diabetes Care, las ventas se mantuvieron planas en un entorno de mercado complicado y volátil. Las ventas de Tissue Diagnostics avanzaron un 9%.
Todas las regiones contribuyeron al crecimiento, aunque el impulso más importante provino de Asia-Pacífico (+15%) y Norteamérica (+6%). En la región EMEA, el mayor mercado de la división, las ventas aumentaron un 2%, mientras que en Latinoamérica lo hicieron un 11% y en Japón un 4%. Professional Diagnostics fue el área que más aportó al crecimiento en todas las regiones.
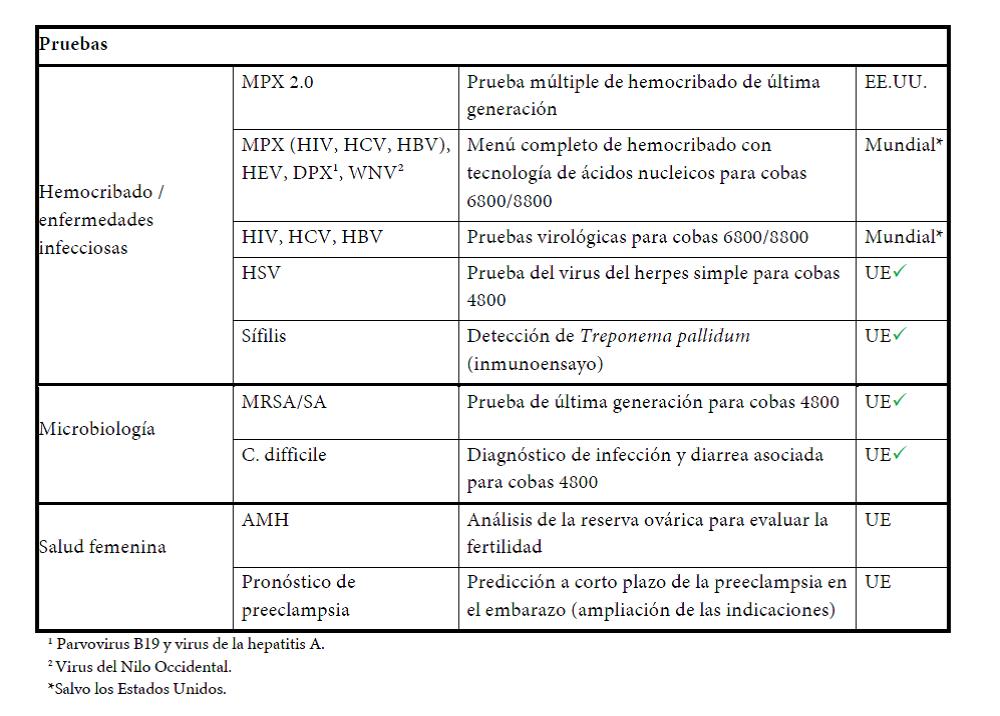
En la primera mitad del año se lanzaron seis productos clave; además, se registró un fuerte crecimiento en las ventas de pruebas diagnósticas asociadas para medicina personalizada y en los ingresos derivados del desarrollo de este tipo de pruebas para empresas externas.
La FDA autorizó el uso de la prueba cobas del virus del papiloma humano (VPH) para el cribado primario de primera línea del cáncer de cuello uterino (cáncer cervicouterino) en mujeres mayores de 25 años, lo que la convierte en la primera y única prueba de VPH autorizada en los Estados Unidos en esta indicación, que también ha sido aprobada en Canadá. Estas autorizaciones suponen un paso importante para las pacientes, ya que ayudan a detectar de forma precoz esta infección causante de cáncer e iniciar más rápidamente el tratamiento.
Desarrollo de ventas por áreas de negocio
- Professional Diagnostics (+9%) creció más que la media del mercado, sobre todo gracias al negocio de inmunodiagnóstico (+12%), que actualmente representa el 26% de la facturación de la división. El crecimiento también se vio impulsado por el negocio de bioquímica clínica (+9%). Professional Diagnostics creció en todas las regiones, destacando Asia-Pacífico (+17%), en particular China, y Norteamérica (+9%). La región EMEA también registró un fuerte crecimiento en inmunodiagnóstico (+7%) y bioquímica clínica (+5%).
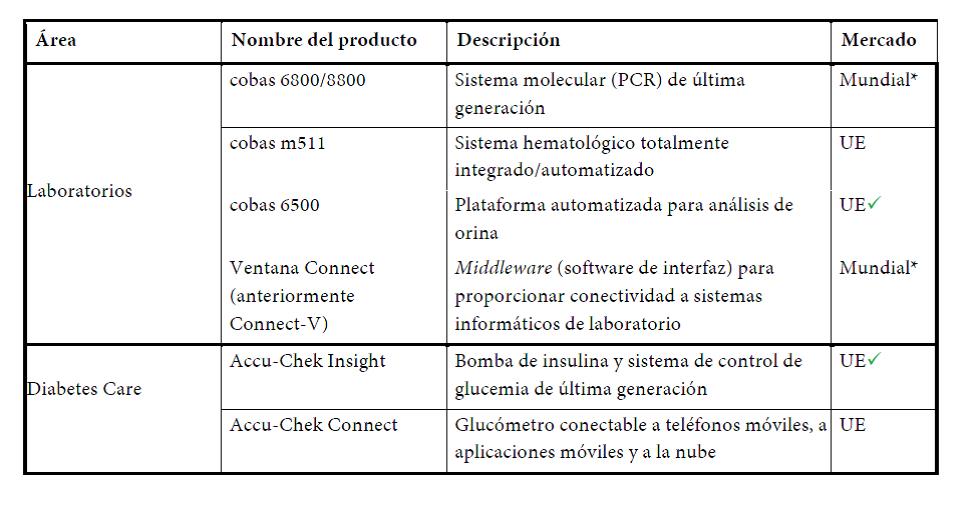
Roche lanzó la serie cobas 6500, un sistema totalmente automatizado de análisis de orina formado por dos analizadores modulares, que combina el análisis de tiras reactivas y la microscopía urinaria digital. El sistema analiza 23 parámetros que ayudan a diagnosticar enfermedades como infecciones urinarias, nefropatías o diabetes.
También se lanzó un nuevo inmunoensayo Elecsys para sífilis, que permite identificar la infección por Treponema pallidum en la práctica clínica habitual y en el análisis de sangre donada. En todo el mundo, unos 12 millones de personas contraen anualmente la sífilis, que puede tratarse más eficazmente si se detecta de forma precoz. Este lanzamiento supone una importante adición al menú analítico puntero de Roche.
- Diabetes Care (0%). La facturación se mantuvo estable en un entorno de mercado difícil. El producto de gama alta Accu-Chek Mobile generó un incremento de la facturación del 22% y las ventas de Accu-Chek Aviva/Performa crecieron un 2%; sin embargo, la caída de las ventas de los productos situados en las etapas finales de su ciclo de vida lastró la facturación total. Las ventas de sistemas de administración de insulina crecieron un 6%. Roche lanzó en Europa el sistema de última generación Accu-Chek Insight, su bomba de insulina con mando a distancia.
Roche Diabetes Care siguió aplicando su programa de reestructuración, que permitirá a este negocio centrarse en los cambios del mercado y aumentar la eficiencia.
- Molecular Diagnostics (+4%). Las ventas crecieron un 6% en los negocios fundamentales de diagnóstico molecular (excluida la secuenciación genómica), impulsadas por las pruebas de detección de infecciones víricas (+5%), el negocio de hemocribado (+7%) y las pruebas de VPH para cribado del cáncer de cuello uterino (+59%). También contribuyeron al crecimiento los reactivos para purificación de ácidos nucleicos y PCR cuantitativa (+4%). El crecimiento de las ventas estuvo en parte contrarrestado por una caída en el negocio de secuenciación genómica. Esta área de negocio lanzó tres pruebas en Europa: para el virus del herpes simple (HSV), MRSA/SA (MRSA/SA: Staphylococcus aureus resistente a la meticilina y Staphylococcus aureus) y Clostridium difficile; las pruebas para MRSA/SA y Clostridium difficile se utilizan para detectar infecciones intrahospitalarias.
Por otra parte, Roche adquirió las empresas IQuum, Inc., centrada en el desarrollo de soluciones de análisis inmediato (point-of-care) para diagnóstico molecular, y Genia Technologies, Inc., que está desarrollando una tecnología de secuenciación de ADN de última generación cuya plataforma de secuenciación de una sola molécula, basada en semiconductores, utiliza tecnología de nanoporos.
- Tissue Diagnostics (+9%). Las ventas se vieron impulsadas por un crecimiento del 8% en tinción avanzada. Las pruebas CINtec Histology y CINtec PLUS Cytology registraron un crecimiento del +11% y el +31%, respectivamente, demostrando la buena acogida e implantación de la cartera de productos de Roche para el cribado del cáncer cervicouterino. Los ingresos derivados de las colaboraciones con compañías farmacéuticas externas siguieron creciendo. Por regiones, el crecimiento se vio impulsado por EMEA (+14%), Norteamérica (+5%) y Asia-Pacífico (+24%). En Norteamérica, la facturación se resintió por cambios en la política de reembolso.
En Tissue Diagnostics se contabilizaron pérdidas en fondo de comercio (259 millones de CHF) y activos intangibles (155 millones de CHF). Estas depreciaciones se debieron principalmente a recortes del reembolso en los Estados Unidos.
Principales lanzamientos de producto previstos para 2014
Acerca de Roche
Roche, cuya sede central se halla en Basilea (Suiza), es una compañía líder del sector de la salud, centrada en la investigación y con la potencia combinada de la integración farmacéutica-diagnóstica. Roche es la mayor empresa biotecnológica del mundo y tiene medicamentos auténticamente diferenciados en las áreas de oncología, enfermedades infecciosas, oftalmología y neurociencias. La compañía es también líder mundial en diagnóstico in vitro, incluido el diagnóstico histológico del cáncer, y pionera en el control de la diabetes. La estrategia de Roche en medicina personalizada tiene como fin proporcionar medicamentos y herramientas diagnósticas que hagan posible mejoras tangibles de la salud, la calidad de vida y la esperanza de vida de los pacientes. Fundada en 1896, Roche lleva más de un siglo contribuyendo de manera importante a mejorar la salud en todo el mundo. La Lista modelo de Medicamentos Esenciales de la Organización Mundial de la Salud contiene veinticuatro medicamentos desarrollados por la compañía, entre ellos antibióticos, antipalúdicos y quimioterápicos que salvan vidas. En el año 2013, el Grupo Roche tenía más de 85.000 empleados, invirtió 8.700 millones de francos suizos en Investigación y Desarrollo y sus ventas alcanzaron la cifra de 46.800 millones de francos suizos. Genentech, en Estados Unidos, es un miembro de plena propiedad del Grupo Roche. Roche es el accionista mayoritario de Chugai Pharmaceutical (Japón). Más información en www.roche.com y www.roche.es
Todas las marcas comerciales mencionadas en este comunicado de prensa están protegidas por la ley.
Para más información:
www.roche.es l Síguenos en Twitter y en YouTube
Departamento de Comunicación Roche Farma España
Rosa Yague
T. 91 324 81 00
spain.comunicacion@roche.com
**
María Zabala
T. 91 787 03 00
mzabala@plannermedia.com